Тема: Явище ізомерії. Структурна ізомерія, номенклатура насичених вуглеводнів.
Мета: Пояснити учням явище ізомерії; ознайомити з міжнародною номенклатурою назв органічних сполук; сформувати уміння складати структурні формули за назвами речовин і давати назви речовинам у відповідності до їх структурних формул; розвивати пам'ять, увагу, уяву, мислення, спостережливість, активність і самостійність учнів; сприяти формуванню наукового світогляду на основі знань про будову та різноманітність органічних речовин.
Обладнання й матеріали: ноутбук, проектор, екран, мультимедійна презентація.
Базові поняття й терміни: ізомерія, ізомери, структурні формули, номенклатура ІЮПАК, вільні радикали.
Тип уроку: урок вивчення нового матеріалу.
ХІД УРОКУ
I ОРГАНІЗАЦІЙНИЙ ЕТАП
II ПЕРЕВІРКА ДОМАШНЬОГО ЗАВДАННЯ
III АКТУАЛІЗАЦІЯ ОПОРНИХ ЗНАНЬ
Бесіда.
1)Як ви думаєте, чому існує така різноманітність органічних речовин? (Карбон з’єднується в ланцюги.)
2) А чи можуть карбонові ланцюжки мати розгалужену будову? (Так, якщо при цьому зберігається валентність Карбону.)
3) Якщо речовини мають однаковий хімічний склад, чи вони матимуть однакові властивості?
4) Якщо речовини мають однаковий склад, чи можуть вони мати різну будову, властивості?
На сьогоднішньому уроці ми знайдемо відповідь на дані запитання. Оголошення теми кроку.
СЛАЙД 1
IV ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. ЯВИЩЕ ІЗОМЕРІЇ.
Розповідь учителя.
Префікс ізо- означає «однаковий». Ізомери мають однаковий склад, але різну будову. Ізомерія — це явище, при якому речовини однакового складу мають різну просторову будову і, відповідно, властивості.
СЛАЙД 2, З
Розглянемо це явище на прикладах. Перший представник алканів — метан.
СЛАЙД 4
Виходячи з валентності Карбону і Гідрогену, атоми в цій молекулі не
можуть бути розташовані по-іншому в просторі, тобто ізомерів у метану немає.
Розглянемо етан.
СЛАЙД 5
Як би ми не повертали молекулу, нового розташування атомів у молекулі не виходить. Просто повертаючи модель молекули в просторі, не можна домогтися різної будови молекули, тобто зміни розташування атомів у молекулі один відносно одного.
Подібним чином розглядається будова молекули пропану.
СЛАЙД 6
Звертається увага на таке явище, як вигини ланцюга. Ординарні зв’язки забезпечують вільне обертання атомів Карбону один відносно одного:
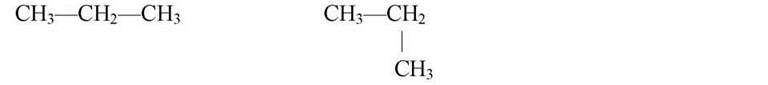
Можна провести аналогію з намистом. Якщо ми зігнемо ниточку з намистинками, то, потягнувши за кінці ниточки, ми легко її випрямимо, приведемо у вихідний стан. Аналогічно, загинаючи карбоновий ланцюг, нічого принципово нового ми не одержимо.
Колективне обговорення.
Розглянемо будову бутану![]() Обертаючи молекулу
Обертаючи молекулу
в просторі або згинаючи карбоновий ланцюжок, не можна одержати ізомери. Можливо, що хто-небудь з учнів запропонує перемістити атом Карбону:
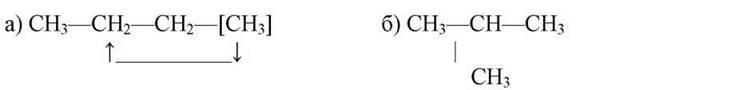
СЛАЙД 7
У процесі обговорення необхідно переконатись, що дійсно утворився ізомер — це видно з того, що середній атом Карбону зв’язаний уже не з двома, а з трьома атомами Карбону і розташування атомів Гідрогену також змінилось
СЛАЙД 8
Аналогічно розглядаються формули ізомерів пентану.
СЛАЙД 9
Таким чином, учні знайомляться з ізомерами бутану і пентану. Виникає питання: як же їх назвати?
2. НАЗВИ ІЗОМЕРІВ.
Розповідь учителя.
Оскільки кожній речовині відповідає лише одна структурна формула, то виникає потреба розрізняти, яка формула якій речовині належить. З цією метою вчені розробляють правила складання індивідуальних назв речовин — номенклатуру.
СЛАЙД 10
Кожна речовина має дві назви — тривіальну (ужиткову) та міжнародну
(систематичну). Систематичну номенклатуру запропонувала Міжнародна спілка теоретичної та прикладної хімії — ІЮПАК. Правила номенклатури насичених вуглеводнів — алканів (парафінів) — такі:
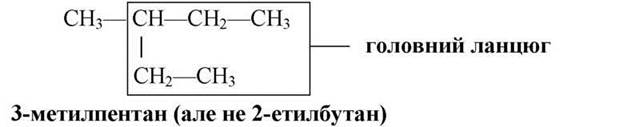
1) У молекулі вибирають найдовший ланцюг і починають нумерувати його з того боку, де ближче стоїть радикал-замісник. Радикал — це хімічно активна частинка, яка утворюється з молекули насиченого вуглеводню, коли він відщеплює один атом Гідрогену. Наприклад: метан СН4 утворює радикал СН3*— метил, етан СгНб утворює радикал С2Н5* — етил, і т. д.
СЛАЙДИ
СЛАЙД 12
Головний ланцюг не обов’язково прямий, можливий вигин головного ланцюга:
СЛАЙД 13
Радикал не може бути прикріплений до кінця ланцюга, це буде тільки загин ланцюга:
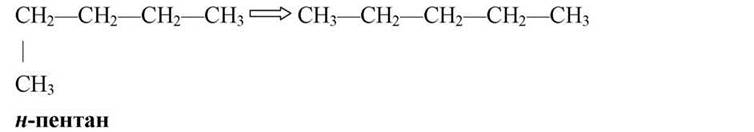
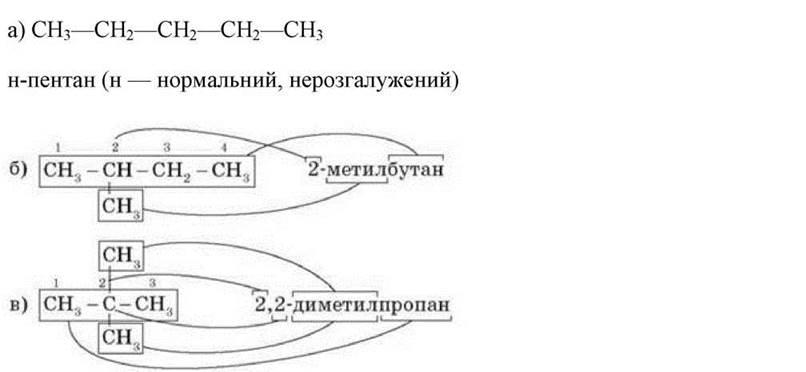
Якщо вуглеводень не має розгалужень карбонового ланцюга, у його назву додають букву «//», тобто пентан нормальної будови.
СЛАЙД 14
2) Цифрою вказують положення радикала-замісника в ланцюжку. Наприклад, 2-метил означає, що від другого атома Карбону відходить радикал метил![]() . А якщо однакових радикалів декілька, то цифрою вказують кожний з них (2,3,4-), але перед назвою радикала ставлять префікс — ди-, три-, тетра- і т. д. Наприклад: 2,3,4-триметил — (три радикали
. А якщо однакових радикалів декілька, то цифрою вказують кожний з них (2,3,4-), але перед назвою радикала ставлять префікс — ди-, три-, тетра- і т. д. Наприклад: 2,3,4-триметил — (три радикали![]() , які відходять від
, які відходять від
2, 3 і 4 атоми Карбону в основному ланцюзі), 2,3,5,7-тетра (чотири). Отже, префікс, указує скільки однакових радикалів містить молекула.
СЛАЙД 15
3) Якщо радикали стоять біля одного й того самого атома Карбону, то
цифру вказують двічі. Наприклад, 2,2-диметил, 2,3,3-триметил і т. д.
4) Якщо радикали різні, то називати їх починають за алфавіту: спочатку етил, метил, пропіл тощо.
5) Остаточну назву речовині дають за кількістю атомів Карбону в нумерованому ланцюзі, не забуваючи, що всі алкани мають суфікс -ан.
СЛАЙД 16
Наприклад:
СЛАЙД 17
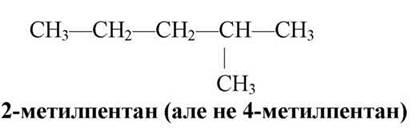
Повертаючись назад, розглянемо ці правила ще раз на ізомерах пентану.
СЛАЙД 18
3. СКЛАДАННЯ СТРУКТУРНИХ ФОРМУЛ РЕЧОВИН ЗА ЇХНІМИ НАЗВАМИ.
Розповідь учителя.
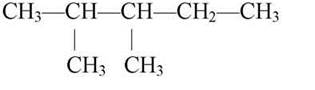
Складемо структурну формулу речовини з назвою 2,3-диметилпентан. Закінчення назви — пентан, отже, у головному ланцюгу п’ять атомів Карбону: С—С—С—С—С .
Частка ди вказує, що в молекулі є два радикали (у даному випадку це радикали ментил СНз*) — замісники атомів Гідрогену біля 2-го і 3-го атома Карбону. Структурна формула:
СЛАЙД 19
V УЗАГАЛЬНЕННЯ І СИСТЕМАТИЗАЦІЯ ЗНАНЬ
Завдання 1.
Назвіть речовини:
СЛАЙД 20
Завдання 2.
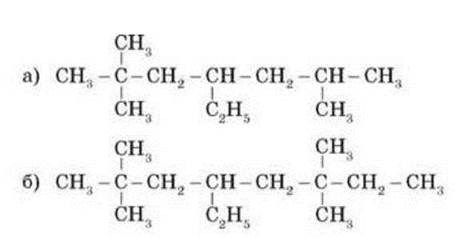
Складіть структурну формулу речовин з назвою:
а) 4-етил-3,3-диметилгептан;
б) 3-етил-2,3,5-триметилнонан;
в) 2,2-диметилоктану;
г) 3,4-диетил-2,5-диметилгексану;
д) 2,3,3-триметилгептану;
е) З-етил-З-метилепентану; є) 3,3,4,4-тетраметигептану;
ж) 2,2,3-триметилпентану;
СЛАЙД 21 VI ДОМАШНЄ ЗАВДАННЯ
1. Вивчити § 2 [1].
2.Виконати завдання 3,4,5 [1,с. 20].
VII ПІДБИТТЯ ПІДСУМКІВ УРОКУ
Використана література та джерела:
1. Ярошенко О. Г.
Хімія : Підручн. для 11 кл. загальноосвіт. навч. закл. (рівень стандарту). — К : Грамота, 2011. — 232 с.: іл.
2. Гранкіна Т. М.
Хімія. 10 клас: Плани-конспекти уроків/ Т. М. Гранкіна, О. В. Григорович. - Вид. З-тс, випр.. X.: Веста: Видавництво «Ранок», 2005. - 272с. - (На допомогу вчителю).
11